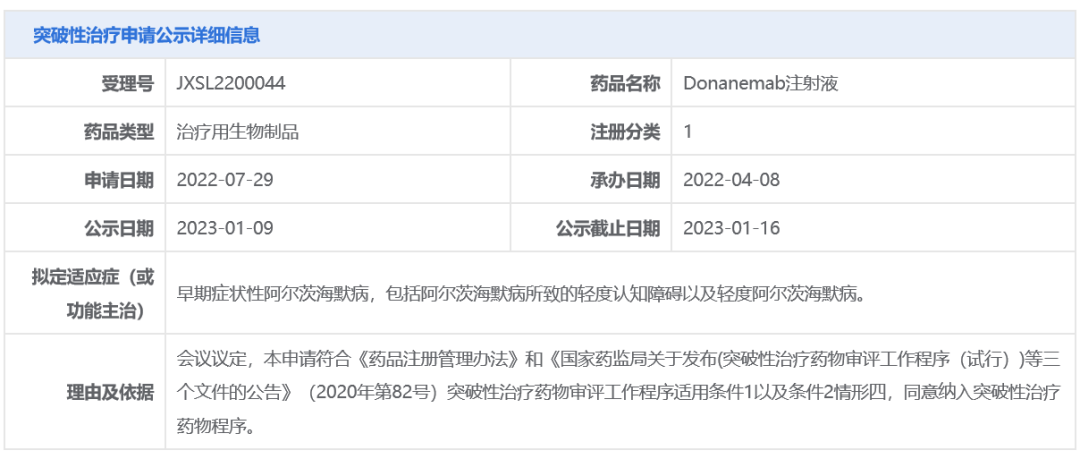
智通財經APP獲悉,1月9日,中國國家藥品監督管理局藥品審評中心(CDE)官網最新公示,$禮來(LLY.US)$(Eli Lilly and Company)申報的1類新藥donanemab注射液擬納入突破性治療品種,擬用於治療早期症狀性阿爾茨海默病,包括阿爾茨海默病所致的輕度認知障礙以及輕度阿爾茨海默病。公開資料顯示,donanemab靶向被稱之為N3pG的β澱粉樣蛋白斑塊,已在美國遞交生物製品許可申請(BLA)並被FDA授予優先審評資格。
據悉,Donanemab是一款與β澱粉樣蛋白亞型N3pG結合的單克隆抗體。它能夠與阿爾茨海默病患者大腦中澱粉樣蛋白沉積中的β澱粉樣蛋白結合,從而促進患者大腦中澱粉樣蛋白沉積的清除。此前,donanemab已經被FDA授予突破性療法認定。2022年8月,FDA接受donanemab的生物製品上市許可申請,並授予其優先審評資格用於加速批準治療早期阿爾茨海默病。
根據禮來早先公布的生物標誌物研究結果,donanemab不但導致澱粉樣蛋白沉積的快速清除,而且顯著降低患者血漿中P-tau217的水平。這是禮來開發的一個在研血液生物標誌物,與澱粉樣蛋白、tau蛋白病理以及阿爾茨海默病的診斷相關。此外,donanemab還能夠降低與大腦星形膠質細胞增生相關的炎症生物標誌物GFAP的水平。這些證據表明該藥能降低與阿爾茨海默病相關的多種病理過程。
在2022年年底召開的阿爾茨海默病臨床試驗大會上,禮來公布了donanemab在一項3期臨床試驗中的積極數據。在治療6個月後,與基線相比,donanemab將早期阿爾茨海默病患者大腦中的澱粉樣蛋白斑塊水平降低65.2%,而活性對照組這一數值為17.0%。這一數據顯示donanemab能夠在治療早期階段迅速有效地改變阿爾茨海默病的生物學。
此前在醫學雜誌上發表的2期臨床試驗結果顯示,donanemab能夠緩解早期阿爾茨海默病患者的認知和日常生活能力的衰退速度。同時,正電子掃描(PET)成像顯示,donanemab能夠迅速清除患者大腦中的澱粉樣蛋白沉積。在接受治療6個月後,40%患者的PET檢測呈陰性,意味著他們大腦中澱粉樣蛋白沉積的水平和健康人沒有顯著區別。
根據中國藥物臨床試驗登記與信息公示平台,禮來公司已於2022年9月在中國啟動一項國際多中心(含中國)、隨機、雙盲、安慰劑對照、3期研究,旨在評估donanemab在存在腦tau蛋白病理的早期症狀性阿爾茨海默病(包括阿爾茨海默病所致的輕度認知障礙以及輕度阿爾茨海默病)受試者中的安全性和有效性。該研究中國部分由首都醫科大學宣武醫院賈建平主任醫師擔任主要研究者,擬在中國近50家研究中心開展,目標入組人數為中國400人。
編輯/ruby